Água Ultrapura para Análise HPLC

Introdução
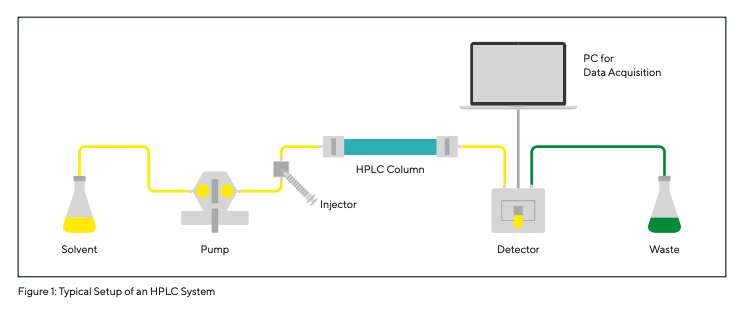
A HPLC é um procedimento analítico para separação, identificação e quantificação de substâncias utilizando cromatografia líquida. Os primórdios da HPLC – Cromatografia Líquida de Alta Pressão – remontam aos anos 60. Graças à melhoria dos materiais de coluna e equipamentos, passou a ser conhecida como Cromatografia Líquida de Alto Desempenho desde o final dos anos 70. Na HPLC, a mistura a ser separada é transferida para uma coluna com um solvente (agente eluente) ou com uma mistura de solventes (eluant|fase móvel), por um injetor e uma bomba. A coluna é um tubo, na maioria dos casos em aço inoxidável, preenchido com a chamada fase estacionária (ver também Fig. 1). A fase estacionária geralmente consiste em gel de sílica porosa ou partículas de polímero com ligandos químicos ligados à sua superfície. Estes ligandos são responsáveis pelas interações seletivas entre os analitos e a fase estacionária, que são necessárias para uma separação cromatográfica eficaz. Dependendo da amostra e da fase estacionária, os mecanismos de separação envolvidos são, por exemplo, adsorção por forças de Van der Waals, troca iônica, exclusão iônica, etc.
As substâncias de uma amostra são retidas no material de embalagem da coluna por diferentes períodos de tempo e, portanto, saem da coluna após diferentes tempos de retenção. Os componentes individuais da amostra são então registrados por um detector e avaliados por um computador. O resultado é um cromatograma (Fig. 1, 5, 6). O número de picos corresponde ao número de componentes separados na amostra, e a área é proporcional à concentração desses componentes separados (de acordo com Kromidas 2000).
Entre as aplicações típicas da HPLC está a análise de açúcares. Esta foi realizada no âmbito de vários testes conduzidos para caracterizar a qualidade das membranas. Por um lado, as membranas foram testadas quanto à sua capacidade de remover moléculas de açúcar e, por outro, a atividade das membranas imobilizadas com enzimas foi determinada. Para tal, açúcares, como rafinose, glicose e frutose, foram ensaiados. Esses tipos de açúcar podem ser detectados especificamente utilizando métodos enzimáticos como o ensaio GOD|POD para glicose ou métodos espectroscópicos, como a determinação de frutose segundo Dische & Borenfreund.
Na análise avançada, o açúcar é agora frequentemente ensaiado por cromatografia em camada fina (TLC), cromatografia gasosa (GC) e cromatografia líquida de alto desempenho (HPLC). Esses métodos são utilizados especialmente quando misturas contendo vários tipos de açúcar devem ser separadas. Na HPLC, conforme descrito aqui, o eluente deve ter uma pureza física e química especialmente alta e não deve conter partículas mecânicas suspensas ou substâncias dissolvidas que possam ser liberadas pela coluna em um momento posterior e, assim, gerar um sinal. A qualidade de um solvente é frequentemente decisiva para a confiabilidade de uma corrida analítica de HPLC. A presença de contaminantes traço durante a eluição em gradiente pode resultar em “picos fantasmas”. Essas substâncias traço se acumulam na coluna durante uma corrida analítica e são liberadas progressivamente quando o agente eluente é posteriormente alterado. A água usada como eluente deve estar livre de microrganismos. Para isso, podem ser adicionadas substâncias que previnam o crescimento de micróbios e algas na mistura de solventes, como sais de cobre ou azida de sódio. Ao fazer isso, as recomendações do fabricante da coluna devem ser seguidas, pois o uso de aditivos incorretos pode resultar em danos irreversíveis à coluna.
A água deionizada ou destilada ainda contém quantidades consideráveis de substâncias orgânicas, que podem causar picos fantasmas. Solventes contaminados podem levar ao acúmulo de depósitos na fase estacionária e, assim, resultar em bloqueio da coluna, que se manifestaria por um aumento de pressão e uma alteração no tempo de corrida das amostras.
Utilização do Arium® Pro VF para Purificar Água para Uso como Eluente
A água da qualidade especial necessária para HPLC pode ser adquirida de vários fabricantes ou produzida diretamente no local para uso sob demanda, utilizando um sistema de purificação de água, como o sistema Arium® Pro VF. O seguinte descreve os testes realizados para separação de misturas de açúcar em que a água ultrapura produzida pelo Arium® Pro VF foi usada como fase móvel (eluente).
Descrição do Sistema de Água Ultrapura Arium® Pro VF
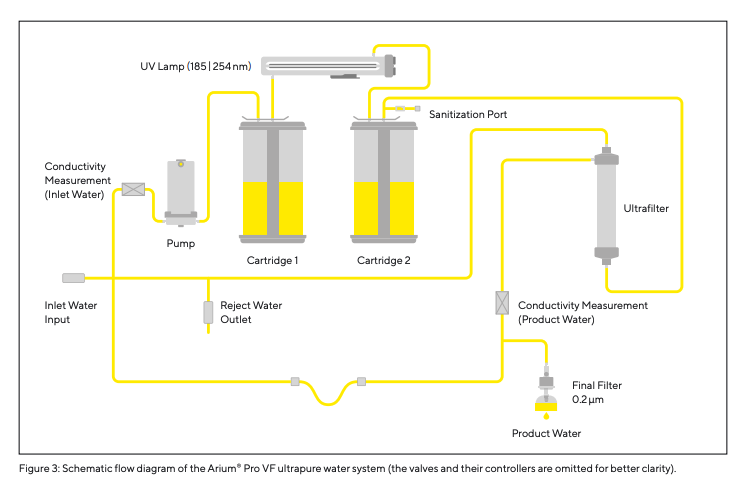
O sistema Arium® Pro VF (Fig. 2) foi projetado para produzir água ultrapura a partir de água potável pré-tratada, removendo contaminantes que ainda estão presentes nessa água. A produção de água ultrapura requer recirculação contínua e uma taxa de fluxo constante, o que é alcançado utilizando um sistema de bomba incorporado com pressão controlada. A condutividade da água é medida na entrada de água de alimentação e diretamente na porta a jusante (saída de água do produto). O sistema Arium® Pro VF utilizado nos estudos descritos neste artigo (um modelo predecessor com as mesmas especificações técnicas que o sistema atualmente redesenhado mostrado na página seguinte) funciona com dois cartuchos diferentes. Estes são preenchidos com um adsorvedor de carbono ativo especial e resinas de troca iônica de leito misto para fornecer água ultrapura com um baixo teor de TOC. Além disso, o sistema possui uma lâmpada UV integrada que tem um efeito oxidante em comprimentos de onda de 185|254 nm. Além disso, o sistema de água ultrapura Arium® Pro VF possui um módulo de ultrafiltração integrado que atua como um filtro de fluxo cruzado. A membrana de ultrafiltração incorporada neste filtro retém coloides, microrganismos, endotoxinas, RNA e DNA. Um filtro final de 0,2 µm instalado na saída de água serve para remover particulados e bactérias durante a dispensação da água ultrapura produzida. O processo que a unidade emprega para purificar a água é ilustrado na Figura 3 (diagrama de fluxo do Arium® Pro VF).
Materiais e Método
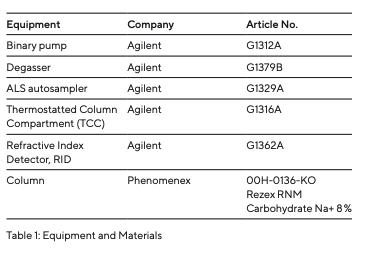
As amostras foram analisadas utilizando um sistema HPLC Agilent 1200 Series (Fig. 4 e Tabela 1) com uma coluna HPLC de Carboidrato Na+ 8% Rezex fornecida pela Phenomenex. Esta coluna é preenchida com um copolímero de poliestireno-divinilbenzeno reticulado modificado por grupos de sulfonato de sódio e utiliza um mecanismo de exclusão iônica. Isso significa que os analitos são separados com base em diferentes interações iônicas. Devido aos grupos de sulfonato na superfície deste material de embalagem da coluna, os poros têm uma carga negativa. Como resultado, moléculas com carga negativa não podem penetrar nos poros do material, o que faz com que eluam mais cedo. Esse mecanismo de exclusão iônica é baseado no equilíbrio de Gibbs-Donnan que governa o comportamento dos íons próximos a uma membrana. Os analitos que conseguem penetrar nos poros da membrana são subsequentemente separados com base em diferenças estéricas, bem como em interações hidrofóbicas e polares com os grupos funcionais na superfície da fase estacionária. Para mais detalhes sobre esse mecanismo de separação, consulte 7.

Os tempos de retenção para vários tipos de açúcar são determinados pela absorbância do sinal do índice de refração (RI). Este sinal de RI é expresso como um número adimensional em Unidades de Índice de Refração Nano (nRIU) e indica a diferença entre o índice de refração da amostra na célula de amostra e a fase móvel na célula de referência. A água ultrapura produzida pelo sistema Arium® Pro VF foi utilizada como fase móvel. Para degasificar o eluente no sistema HPLC, essa água ultrapura foi filtrada a vácuo através de uma unidade descartável Sartolab BT 500 Bottle Top equipada com uma membrana de 0,2 µm (Sartorius Sartolab BT 180C5).
Procedimento para Análise HPLC
Para se preparar para as corridas analíticas, a coluna Rezex foi aquecida a 75°C no compartimento da coluna (aquecedor) e lavada durante a noite com água ultrapura Arium® Pro VF a 0,6 mL/min. A unidade óptica do detector de RI foi aquecida a 35°C. As amostras a serem analisadas foram preparadas utilizando água ultrapura Arium® Pro VF e pré-filtradas através de uma unidade de filtro de seringa de 0,2 µm (Sartorius Minisart® RC4, nº 17822). As amostras foram analisadas utilizando HPLC de acordo com os parâmetros definidos por um método de HPLC (Tabela 2).


Resultados
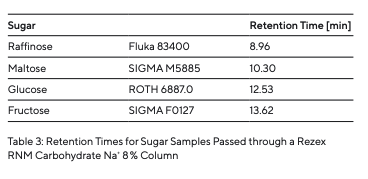
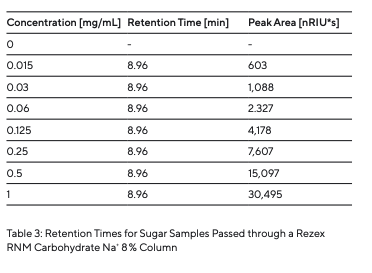
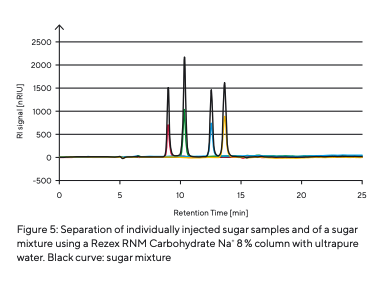
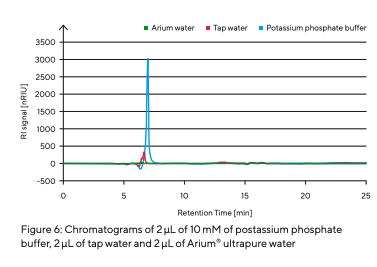
Para determinar os tempos de retenção dos diferentes tipos de açúcar (Tabela 3), estes foram preparados e injetados individualmente (Fig. 5). Como diferentes açúcares interagem com a fase estacionária em graus variados, tempos de retenção específicos são registrados pelo detector de RI assim que cada açúcar atravessa a coluna. Após a determinação dos diferentes tipos de açúcar, uma mistura de açúcar foi preparada e separada (Fig. 5). Os componentes individuais de açúcar foram separados uns dos outros. Os picos dos diferentes tempos de retenção puderam ser atribuídos às amostras individuais de açúcar analisadas. O efeito de contaminantes ou a influência de sais foi simulado pela injeção de um tampão de fosfato de potássio e água da torneira (Fig. 6).
A injeção de água da torneira com uma condutividade de 265 µS/cm e do tampão de fosfato de potássio com uma condutividade de 1.700 µS/cm apresentou sinais claros e, portanto, pode ser claramente identificada como contaminação.
Íons com múltiplas cargas são especialmente propensos a se ligarem a grupos sulfonato. Isso altera o equilíbrio de dissociação e pode afetar o tempo de retenção de um açúcar específico. Por esse motivo, a fase móvel deve estar livre de sais e outros contaminantes para realizar análises HPLC confiáveis com tempos de retenção estáveis e evitar picos fantasmas. A água ultrapura Arium® utilizada nesta análise tem uma condutividade de 0,055 µS/cm e está praticamente livre de contaminantes interferentes, o que se expressa como uma linha de base plana sem picos (veja a linha de base verde na Fig. 6). A pressão da coluna durante as corridas analíticas permaneceu consistentemente em 23 bar (~334 psi).
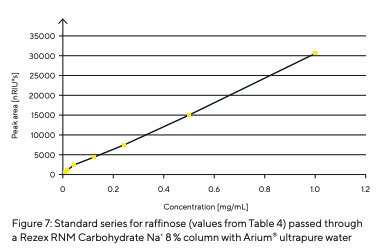
Isso mostra que não se formaram depósitos na coluna. Corridas em branco no início e no final não mostraram nenhuma mudança; ou seja, não havia contaminantes na fase móvel. Séries padrão com diferentes concentrações foram analisadas para determinar a reprodutibilidade e o limite de detecção. A rafinose é dada como um exemplo dessas séries realizadas. Os tempos de retenção e as áreas dos picos foram registrados e estão listados na Tabela 4. Os tempos de retenção consistentes obtidos repetidamente mostram excelente reprodutibilidade. A série padrão de rafinose apresenta uma curva linear até uma concentração de 0,015 mg/mL (Fig. 7). Ao gerar uma linha reta padrão com base nas áreas dos picos, é possível a quantificação da amostra, neste caso, rafinose.
Conclusão
Os resultados mostram que a água ultrapura produzida pelo sistema Arium® Pro VF pode ser utilizada com facilidade como fase móvel para análises HPLC dos sacarídeos solúveis em água descritos neste artigo. As interações da amostra com a fase estacionária não são afetadas pela fase móvel, uma vez que a água ultrapura produzida, com uma condutividade de 0,055 µS/cm, pode ser considerada virtualmente livre de contaminantes. Como resultado, não há sais presentes que poderiam causar picos fantasmas. Além disso, os resultados dos testes levam à conclusão de que não ocorrem depósitos na fase estacionária, o que, de outra forma, se manifestaria por um aumento da pressão e uma mudança nos tempos de execução das amostras.
Portanto, a água ultrapura Arium® Pro VF, que pode ser preparada sob demanda a qualquer momento, oferece uma alternativa acessível à água ultrapura vendida comercialmente para preparar eluentes de alta pureza para análises HPLC, como aquelas utilizadas na análise de alimentos, análise ambiental, bem como em pesquisas médicas, químicas e bioquímicas, além de testes de controle de qualidade em processo nas indústrias farmacêutica e biotecnológica.
Os estudos realizados e a excelente experiência obtida ao usar água ultrapura Arium® Pro VF como fase móvel em HPLC serão estendidos em um futuro próximo a outras tecnologias de separação, como cromatografia em fase reversa, cromatografia de exclusão por tamanho ou cromatografia líquida de ultralta performance.