Escalonamento da cultura de E. Coli para uma estratégia de alimentação otimizada em modo fed-batch usando alimentação exponencial
A Escherichia coli é um dos sistemas de expressão mais populares para a produção de proteínas recombinantes. Neste estudo, foi realizado um protocolo breve para aplicar um modo fed-batch em escala laboratorial com E. coli e o seu escalonamento para 30 litros. A alta densidade celular do crescimento de E. coli foi alcançada utilizando um modo fed-batch num biorreator de bancada Bionet F1, após a caracterização em modo batch, utilizando uma sonda de densidade ótica online para registar automaticamente o crescimento. Foi obtida uma taxa de crescimento específica de 0,46h-1, resultando numa concentração de biomassa 7 vezes maior com a estratégia fed-batch, em comparação com o modo batch alternativo. O processo desenvolvido em escala laboratorial foi escalonado com um fator de 10, sob o critério de coeficientes volumétricos de transferência de oxigénio (kLa) constantes, num biorreator Bionet F2-30A em escala piloto.
INTRODUÇÃO
A expressão de proteínas na bactéria E. coli tem sido o sistema de expressão mais popular há mais de duas décadas para a produção de proteínas recombinantes, devido à sua capacidade melhorada de alcançar rapidamente altas densidades celulares em meios de cultura económicos, com curto tempo de cultivo, fácil manipulação genética, baixo custo dos meios e status regulatório aprovado para aplicações em humanos e animais.
Para o escalonamento da fermentação aeróbia, o efeito do transporte de massa gás-líquido é o fator mais significativo. Portanto, o escalonamento na fermentação aeróbia é frequentemente realizado com base na manutenção do coeficiente de transferência de massa volumétrica (kLa) constante em todas as escalas.
O sucesso do processo de escalonamento é geralmente confirmado por resultados experimentais, mostrando diferenças limitadas entre a fermentação em pequena e em grande escala, realizadas sob a mesma taxa de transferência de oxigénio.
No presente trabalho, o crescimento de uma estirpe de E. coli foi caracterizado em escala laboratorial usando o biorreator Bionet F1, através de medições de densidade ótica online para estabelecer a taxa de alimentação ideal do substrato em modo fed-batch na fase exponencial. Com os dados obtidos, o processo foi escalonado para um fermentador de 30 litros, usando o biorreator Bionet F2-30A e aplicando uma proporção de escalonamento de cerca de 1:10.
MATERIAIS E MÉTODOS
Equipamento • Biorreatores/Fermentadores. A Tabela 1 apresenta uma descrição completa do equipamento utilizado: – Biorreator de Bancada Bionet F1-3MB (Fig. 1) com o Software ROSITA® para controlo e monitorização. – Biorreator Bionet F2-30A (Fig. 2) com o Software MARTA® para controlo e monitorização.

Fig. 1: Biorreator de Bancada Bionet F1-3MB utilizado para a caracterização e otimização do processo. Esta é uma das soluções autoclaváveis de nível de entrada da BIONET para aplicações de microbiologia e cultura de células em biorreatores de tanque agitado. Disponível em modelos com volumes de trabalho de 1, 3, 5, 8 e 10L, e em configurações simples ou duplas.

Fig. 2: Biorreator em aço inoxidável Bionet F2-30A utilizado para o escalonamento, configuração autónoma (não é necessária instalação de vapor para esterilização). Disponível em modelos com volumes de trabalho de 15 e 30L, e em configurações autónomas ou não autónomas para esterilização.
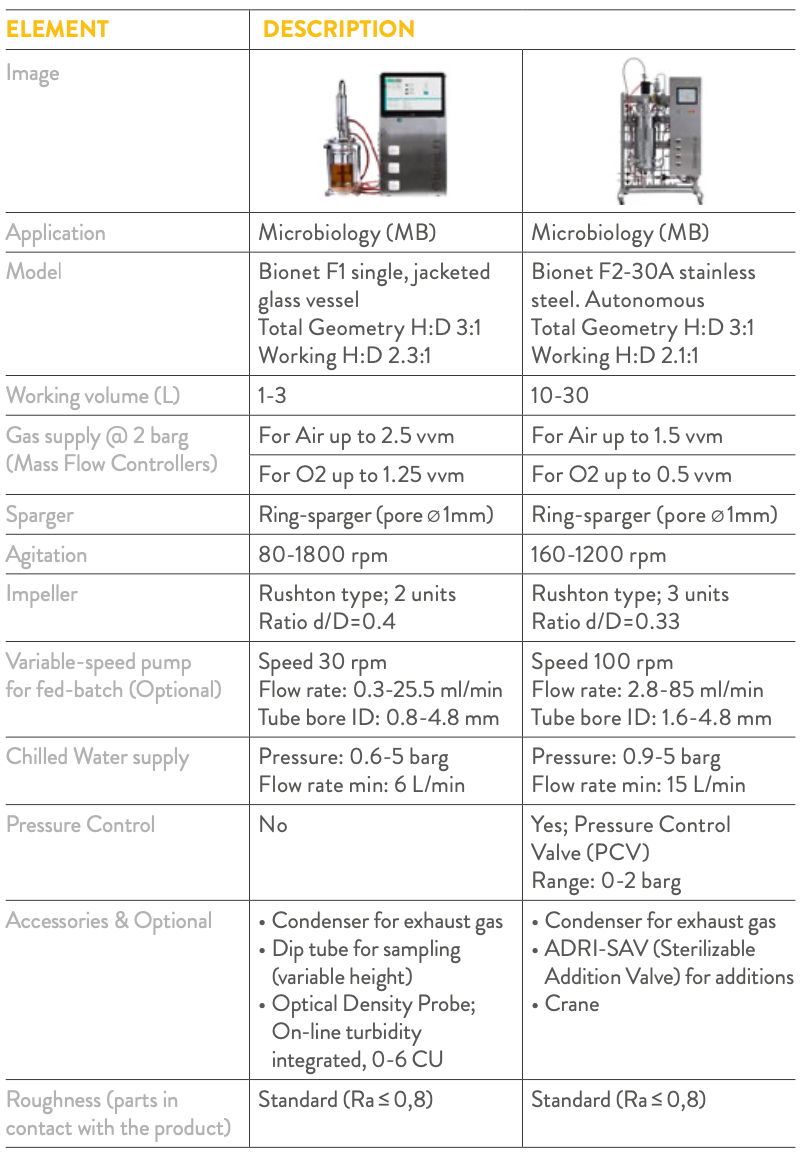
Tabela 1: Comparação das configurações dos biorreatores da Bionet para o processo de fermentação de E. coli em modo fed-batch.
Meios
Salvo indicação em contrário, todos os reagentes utilizados neste trabalho foram adquiridos na Sigma-Aldrich (St. Louis, MO, EUA) ou na Scharlab (Barcelona, Espanha).
Inóculo
• Caldo Luria-Bertani (LB) • Caldo Terrific (TB) • Glicose (GLU) • Ampicilina (antibiótico) • Isopropil-β-D-tiogalactopiranosídeo (IPTG) • MgSO4·7H2O • NH4OH e H3PO4 • Antiespumante Sigma 204
Estrains recombinantes BL21 de E. coli provenientes de um banco de células de trabalho (WCB) foram propagadas em frascos de 250 ml, contendo 50 ml de caldo Luria-Bertani (LB), 50 μg·mL^-1 de ampicilina e 4 g·L^-1 de glicose durante 12 horas a 37°C e 250 rpm em um agitador orbital, até alcançar uma OD600nm entre 0,6 e 0,9 para a inoculação no biorreator de 3 litros. A relação do inóculo entre todas as etapas e escalas foi de 1% v/v; portanto, para a operação equivalente no processo de fermentação em 30 litros, os frascos de estoque do WCB foram propagados em frascos de 1000 ml, contendo 200 ml de LB, 50 μg·mL^-1 de ampicilina e 4 g·L^-1 de glicose.
Fermentação
Os ensaios de fermentação foram realizados em dois experimentos separados:
i. Caracterização e otimização em escala laboratorial • Modo batch para calcular a taxa de crescimento específica (μ) da estirpe. • Modo fed-batch utilizando um controle de taxa de alimentação ótima.
ii. Escalonamento de 3 litros para 30 litros • Modo fed-batch utilizando um controle de taxa de alimentação ótima baseado na caracterização em escala de bancada, e sob o critério de coeficientes volumétricos de transferência de oxigênio (kLa) constantes.
Para todos os experimentos, células do inóculo em meio LB foram propagadas em biorreatores Bionet, contendo no início da fase batch 65% do volume final da fermentação. A composição inicial do meio era 47 g·L^-1 de caldo Terrific (TB), suplementado com 10 g·L^-1 de glicose e contendo 0,5 g·L^-1 de antiespumante. Antes da inoculação com as células, os biorreatores foram esterilizados com o meio durante 30 minutos a 121°C, utilizando um autoclave para o biorreator de vidro (Bionet F1-3MB) e esterilização no local (SIP) para o biorreator de aço inoxidável (Bionet F2-30A). A glicose foi esterilizada em um autoclave e adicionada ao meio após a esterilização do biorreator. 50 mg·L^-1 de ampicilina como antibiótico foi adicionada após a esterilização e imediatamente antes da inoculação das células. Durante todos os experimentos, o pH foi mantido em 7±0,2 adicionando NH4OH ou H3PO4, a temperatura foi mantida a 37°C para a primeira fase e a 30°C para a fase de expressão da proteína, e o oxigênio dissolvido foi mantido em 30±1% de saturação, regulando a agitação e as taxas de aeração com controle em cascata DO2.
Modo batch em 3 litros Culturas no biorreator Bionet F1-3MB foram cultivadas até atingir uma OD600 nm de 0,6-0,9, após o qual IPTG foi adicionado a uma concentração final de 0,5 mM para a indução da expressão da proteína recombinante. A incubação continuou por 8 horas para a produção da proteína recombinante. A densidade ótica foi monitorizada online com um sensor de turbidez conectado ao biorreator e integrado ao software de controlo ROSITA®.
Modo fed-batch em 3 litros A primeira etapa antes da indução foi equivalente ao modo batch com OD600 nm de 0,9, com a adição de IPTG a 0,5 mM para a concentração final para indução da expressão da proteína recombinante. Então, quando o oxigênio dissolvido aumentou, atingindo um valor superior a 90%, o modo fed-batch foi iniciado automaticamente, ativando uma bomba de velocidade variável para a adição de uma solução de glicose a 100 g·L^-1, previamente esterilizada, contendo uma solução de MgSO4·7H2O a 18,7 g·L^-1. Esta solução foi previamente esterilizada por microfiltração com um tamanho de poro de 0,2 μm, começando com uma taxa de alimentação inicial e aumentando exponencialmente com a função exponencial do software de controle (Fig. 2), de acordo com a versão simples da equação para alimentação exponencial [3]. A taxa de crescimento específica foi controlada para 0,2 h^-1. A alimentação de glicose foi mantida até que uma OD600 nm de 80±10 fosse alcançada:
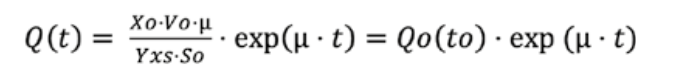
- Q(t): Taxa de fluxo da solução de alimentação (L·h^-1)
- Xo: Densidade celular inicial em g·L^-1 de peso celular seco (DCW)
- Vo: Volume inicial (L)
- μ: Taxa de crescimento específica (h^-1)
- Y·xs: Coeficiente de rendimento da biomassa (gDCW/g·glicose)
- So: Concentração do substrato na solução de alimentação (g·L^-1)
- t: Tempo (h)
Escalonamento de 3 litros para 30 litros
Neste estudo, foi aplicado um escalonamento, sob o critério constante do coeficiente de transferência de massa volumétrica KLa, com uma combinação de uma faixa de velocidade constante da ponta do agitador. O KLa foi calculado utilizando o método dinâmico físico [4], de acordo com a equação para a determinação da taxa de transferência de oxigênio (OTR).
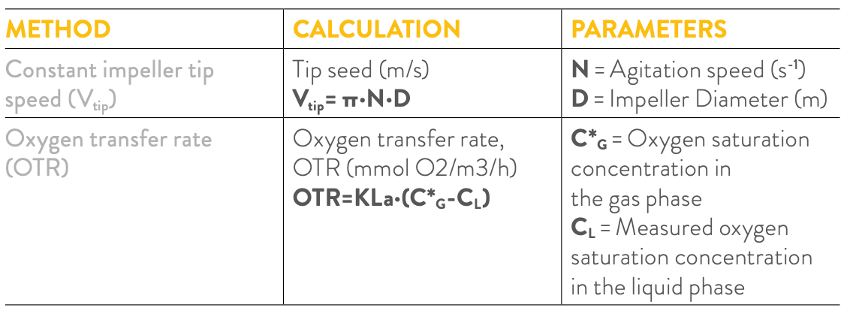
Tabela 2: Resumo dos critérios para o escalonamento do processo de fermentação utilizados neste estudo.
Centrifugação
Para calcular o rendimento final de biomassa em glicose como Yx/s, uma amostra do caldo colhido foi centrifugada a 4500 × g à temperatura ambiente (RT) por 15 minutos, utilizando uma centrífuga OrtoAlresa modelo Dicigen 21, com rotor RT 138. O pellet obtido foi seco a 100°C durante 1 hora, para medir o peso celular seco (DCW).
RESULTADOS
Fermentação em Escala de Bancada Os dados de crescimento celular foram coletados para análise do processo a partir de um arquivo CSV gerado pelo software ROSITA® da Bionet, para a escala de bancada. A taxa de crescimento (μ) no modo batch com glicose como substrato limitante foi calculada a partir da curva de crescimento plotada em escala logarítmica (Fig. 3). A taxa de crescimento específica obtida para esta estirpe com glicose na fase logarítmica foi μ = 0,46h−1
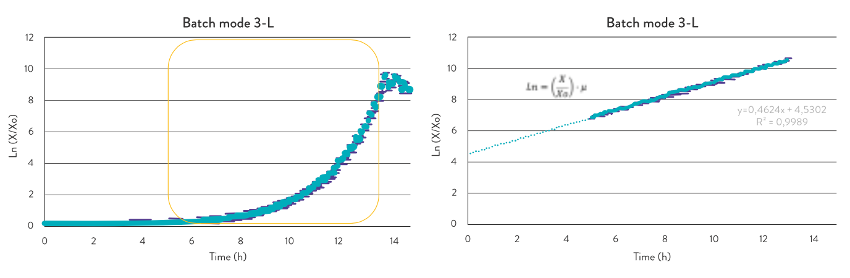
As condições ótimas de taxa de alimentação da estratégia fed-batch foram estabelecidas 40% abaixo da taxa de crescimento específico máxima calculada no modo batch, para garantir o consumo completo da glicose. Quando a cultura alterou a tendência do DO2, indicando a exaustão completa do substrato limitante 3 horas após a indução, a adição da solução concentrada de glicose foi iniciada automaticamente a partir da receita programada no software da Bionet.
A concentração final de biomassa no modo fed-batch foi de cerca de 25 g·L^-1 de peso celular seco (DCW), e o coeficiente de rendimento da biomassa YX/S foi de 0,63 g/g·glicose. Estes resultados foram semelhantes aos reportados por outros autores [5].
Escalonamento para 30 Litros
Os critérios mais comuns para o escalonamento de laboratórios para a escala piloto e da escala piloto para a escala de produção ou de planta são manter um ou mais parâmetros semelhantes entre as diferentes escalas. Normalmente, é impossível manter todos os parâmetros na mesma proporção entre si. Estes parâmetros incluem a velocidade da ponta do agitador, a taxa de transferência de oxigênio (OTR), o coeficiente de transferência de massa de oxigênio (kLa), a potência por unidade de volume do biorreator, o tempo de mistura e o número de Reynolds do agitador. A concentração constante de DO2 também é utilizada como um parâmetro de escalonamento para a produção de proteínas recombinantes [6]. Para o escalonamento da fermentação aeróbica, o efeito do transporte de massa gás-líquido é o fator mais significativo.
O critério da velocidade da ponta do agitador tem algumas vantagens em processos biotecnológicos com microrganismos sensíveis ao estresse de cisalhamento produzido por um agitador, pois determina o estresse de cisalhamento máximo no tanque, o que pode causar danos às células [2]. A Tabela 3 mostra uma comparação da velocidade da ponta do agitador calculada para os biorreatores F1-3MB e F2-30 da Bionet em diferentes regimes de agitação (N), correlacionados de acordo com o diâmetro do agitador (D).
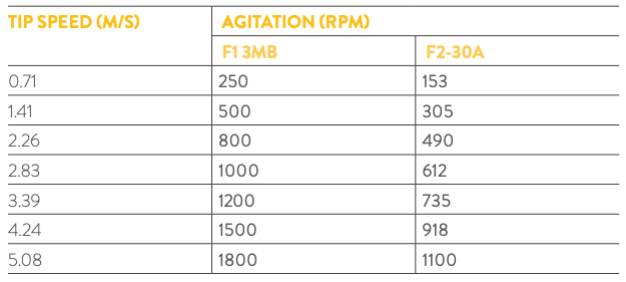
Tabela 3: Correlação entre as velocidades da ponta (m/s) e as velocidades de agitação (rpm) para as duas escalas. Foi calculado um intervalo de KLa’s usando o método físico dinâmico [4], de acordo com a equação para a determinação da taxa de transferência de oxigênio (OTR), para uma velocidade mínima e máxima da ponta de 1,41 m/s e 4,24 m/s, respetivamente, com uma taxa de fluxo de ar na faixa de 0,5-1,5 vvm e a temperatura a 37°C, utilizando o meio sem microrganismos (Fig. 4). O processo foi estabelecido para manter um valor de KLa na faixa de 50-120 h^-1, variando a agitação com o controle em cascata de DO2, com uma velocidade equivalente da ponta do agitador na faixa de 1,41-3,39 m/s e mantendo a taxa de fluxo de ar constante em 1 vvm. Como valor de referência, a caracterização preliminar do biorreator F1-3MB da Bionet determinou um valor máximo de KLa de 300 h^-1, correspondente ao OTR máximo do equipamento de aproximadamente 350 mmol·O2·L^-1·h^-1 (dados não publicados).
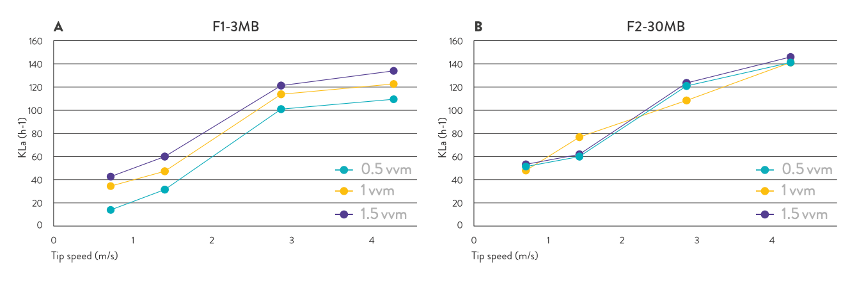
Fig. 4: Coeficiente de transferência de massa volumétrica (KLa) como função da velocidade do agitador a 37°C com o meio utilizado, e diferentes taxas de fluxo de ar realizadas nos biorreatores da Bionet (A) F1-3MB e (B) F2-30A.
Em média, culturas de E. coli com uma OD600nm de 75 e uma DCW de 25 g/L foram alcançadas em ambas as escalas durante 20 horas do processo, conforme mostrado na Figura 5. Uma breve descrição da configuração dos parâmetros do processo está apresentada na receita descrita na Tabela 4 para ambas as escalas.
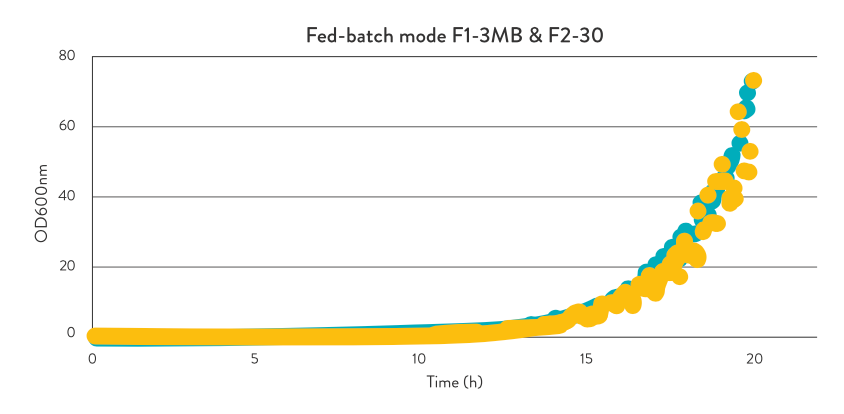
Fig. 5: Comparação da evolução temporal dos dados de densidade óptica online exportados do software ROSITA® e MARTA® dos biorreatores Bionet F1-3MB e F2-30A, respetivamente, a partir dos ensaios de escalonamento no modo fed-batch.
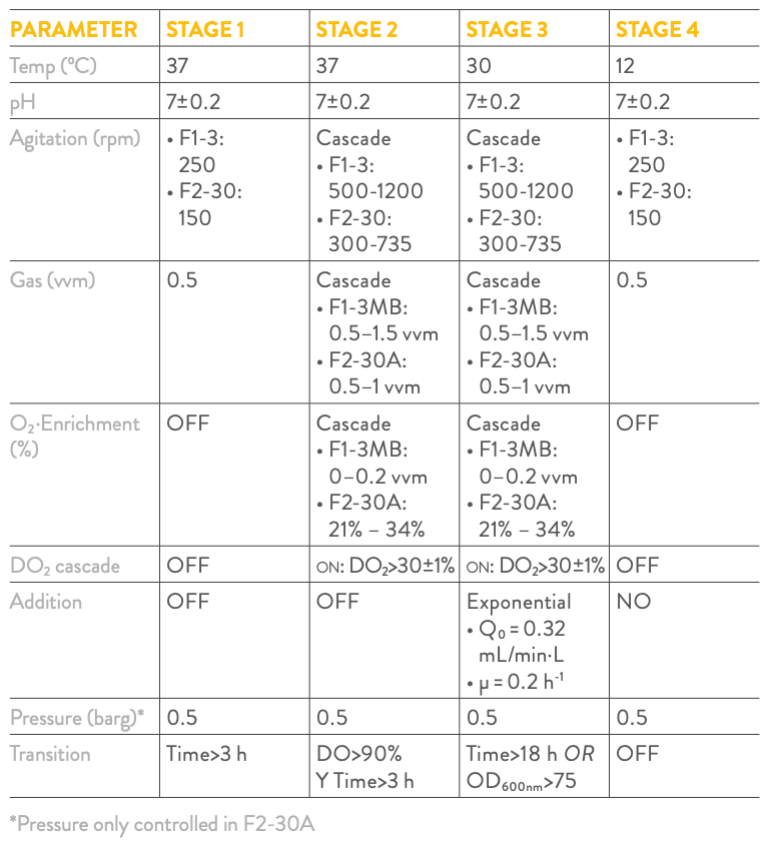
Tabela 4: Configuração da receita para o processo de fermentação de E. coli em modo fed-batch utilizando biorreatores Bionet.
Conclusões:
A alta densidade celular no processo de E. coli foi alcançada utilizando um modo fed-batch no biorreator Bionet F1 Bench-top e o escalonamento para o biorreator piloto F2-30, com a automação das etapas críticas do processo programadas com o software ROSITA® e MARTA®, respetivamente. A estirpe foi previamente bem caracterizada em modo batch, através da coleta de dados online e simplificação dos cálculos de crescimento, para obter a taxa de crescimento específica. Ao aplicar esta taxa de crescimento de forma ideal como uma taxa de alimentação exponencial em fed-batch, foi obtido um rendimento de biomassa 7 vezes superior ao do modo batch.
O escalonamento bem-sucedido para o fator 10 foi alcançado no biorreator Bionet F2-30. Além de uma boa caracterização da estirpe utilizada e critérios de escalonamento bem definidos, o conhecimento técnico adequado do equipamento, em termos de caracterização do processo em todas as escalas de produção, também é de importância fundamental para garantir a confiabilidade e a reprodutibilidade dos resultados do escalonamento do processo.